pH معیاری برای سنجش اسیدی یا بازی بودن است
تعریف pH و واحدهای اندازهگیری
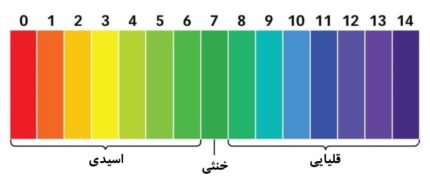
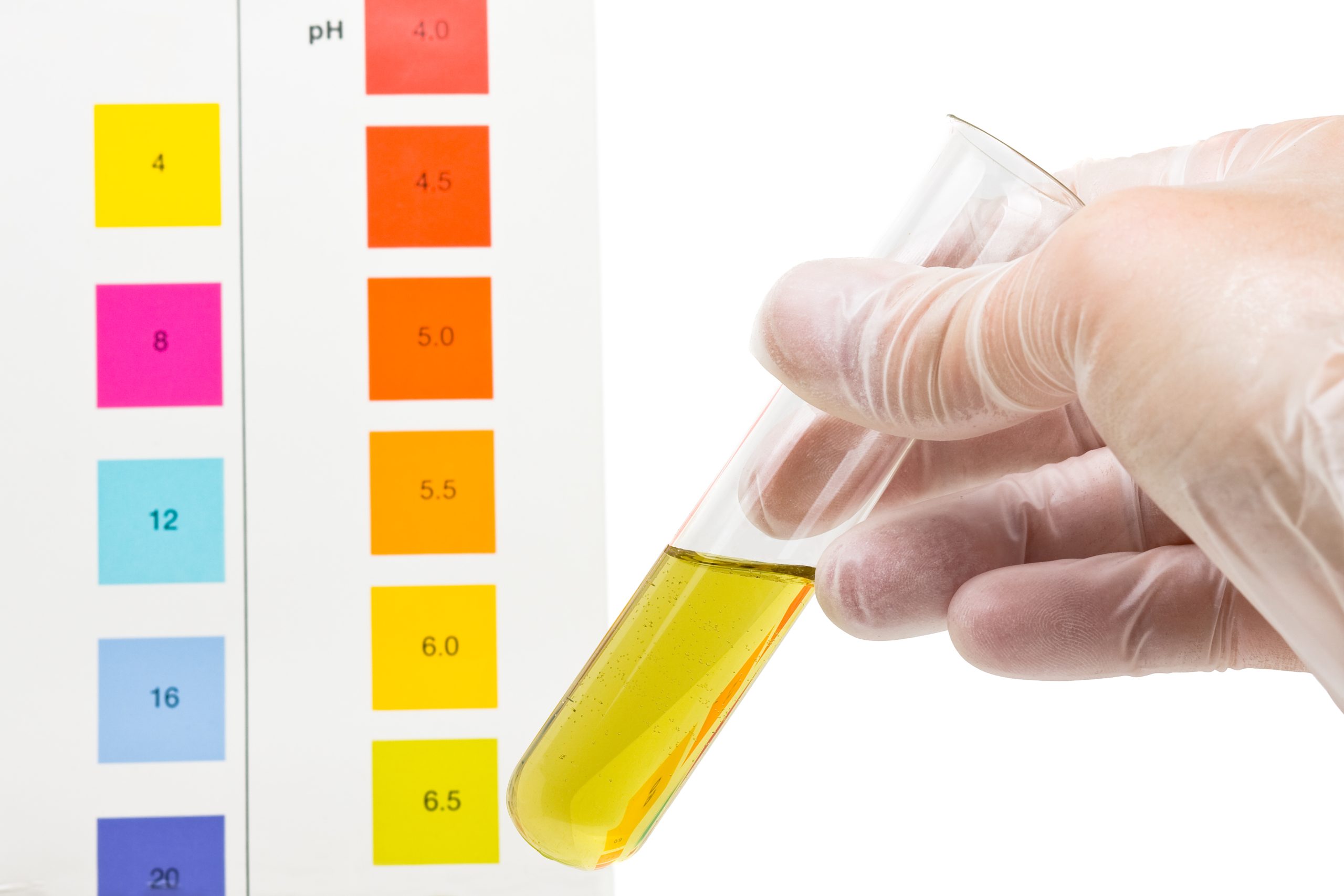
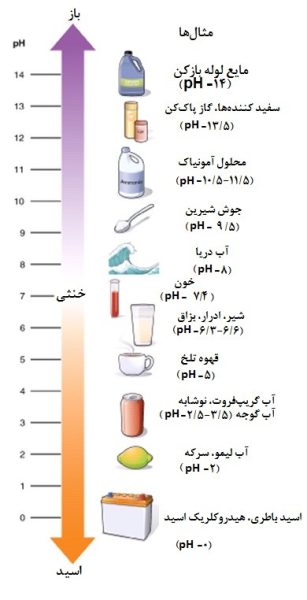
pH معیاری از میزان اسیدی یا بازی بودن آب است. دامنهی پی اچ از ۰ تا ۱۴ متغیر است. پی اچ ۷ خنثی، pH کمتر از 7 نشاندهندهی اسیدیته و pH بیشتر از 7 نشاندهندهی قلیایی بودن است.
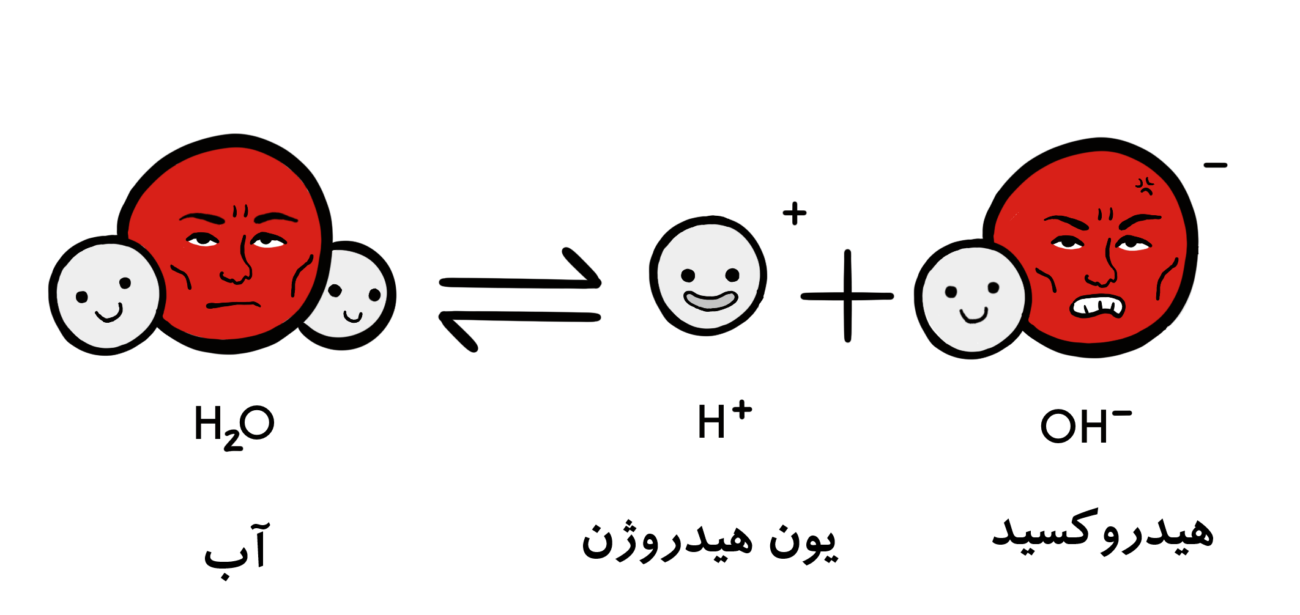
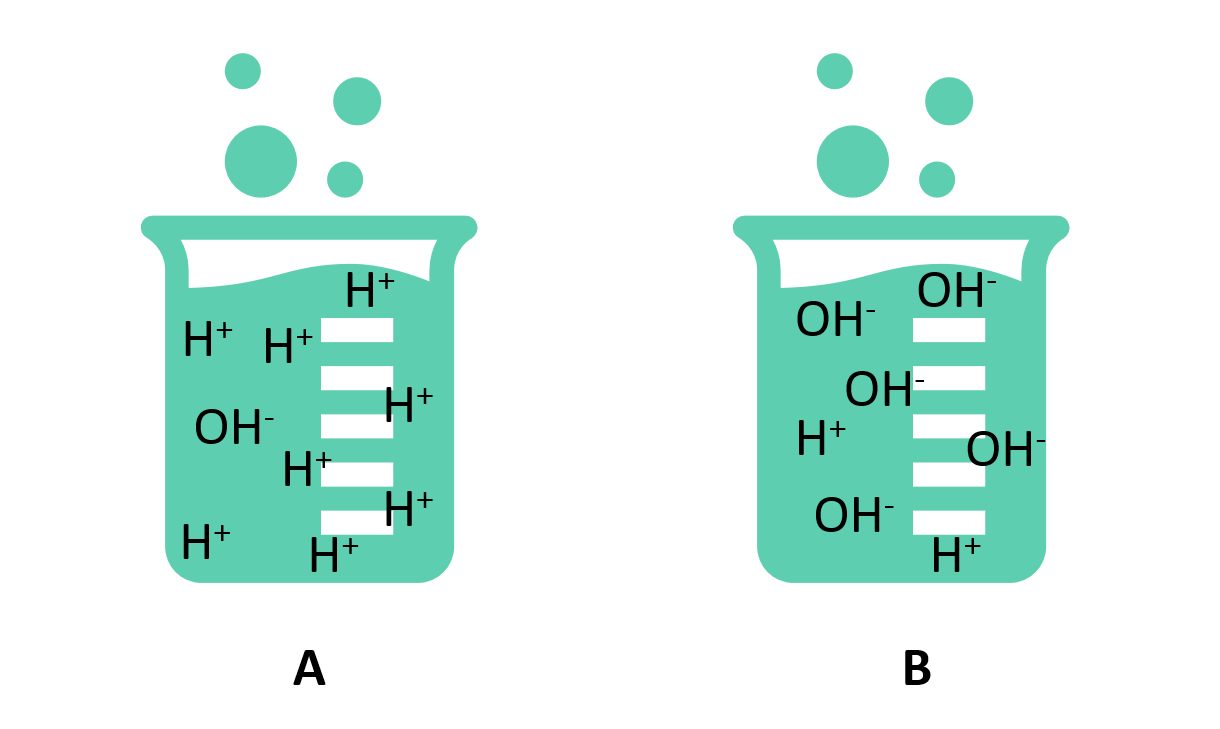
در واقع pH معیاری از مقدار نسبی هیدروژن آزاد و یونهای هیدروکسیل موجود در آب است. آبی که یونهای هیدروژن آزادِ بیشتری داشته باشد اسیدی است، در حالی که آبی که یونهای هیدروکسیل آزاد بیشتری داشته باشد بازی است. از آنجا که pH میتواند تحتتاثیر مواد شیمیایی موجود در آب قرار گیرد، شاخص مهمی از آب است که به صورت شیمیایی تغییر میکند. pH در “واحدهای لگاریتمی” گزارش میشود. هر عدد نشاندهندهی یک تغییر ۱۰ برابری در قدرت اسیدی یا بازی بودن آب است. آبی که pHاش ۵ است، ده برابر بیشتر از آبی با 6=pH دارد اسیدی است. pH آب یک کمیت بسیار مهم در مورد کیفیت آب است.
pH و آب
معمولا از یک گوینده اخبار محلی نمیشنوید که بگوید “مردم! مقدار pH امروز در رودخانهی درایوویل (Dryville Creek) 3.6 است!” اما pH یکی از معیارهای مهم در مورد آب است. شاید برای یک پروژه علمی در مدرسهتان pH نمونههای آب را در کلاس شیمی اندازه گرفته باشید…. در مرکز اندازهگیری زمینشناسی ایالات متحده هر زمان که آب مورد مطالعه قرار میگیرد، اندازهگیری pH هم انجام میشود. نه تنها pH یک جریان آبی بر موجوداتی که در آب زندگی میکنند تاثیر میگذارد، بلکه تغییر pH در یک جریان میتواند شاخص افزایش آلودگی یا برخی عوامل محیطی دیگر باشد.
اهمیت pH
pH آب، حلالیت (مقدار مادهای که میتواند در آب حل شود) و در دسترسیِ زیستی (مقدار مادهای که میتواند توسط زندگی آبی مورد استفاده قرار گیرد) ترکیبات شیمیایی مانند مواد مغذی (فسفر، نیتروژن و کربن) و فلزات سنگین (سرب، مس، کادمیم و غیره) را تعیین میکند. به عنوان مثال، pH علاوه بر تاثیرگذاری بر میزان و نوع فسفر موجود در آب، این نکته را هم تعیین میکند که آیا زندگی آبی میتواند از این فسفر استفاده کند یا خیر. در مورد فلزات سنگین، میزان حلالیت یا سمی بودنشان را تعیین میکند. فلزات در pH پایینتر، سمی بودن بیشتری دارند، چون محلولتر هستند.
نمودار pH
همانطور که این نمودار شکل زیر نشان میدهد، pH از ۰ تا ۱۴ تغییر میکند و ۷ خنثی است. pHهای کمتر از ۷ اسیدی هستند، در حالی که pHهای بزرگتر از ۷ قلیایی (بازی) هستند. باران معمولی به خاطر گاز دیاکسید کربن موجود در اتمسفر، pH حدود 6/5- کمی اسیدی دارد. میتوانید ببینید که باران اسیدی میتواند خیلی اسیدی باشد و میتواند تاثیراتی منفی بر محیطزیست بگذارد.
اندازهگیری pH
سازمان زمینشناسی ایالاتمتحده هر ساله صدها هزار نمونه آب را تحلیل میکند. اندازهگیریهای زیادی درست در محل میدان انجام میشود، و اندازهگیریهای بیشتری بر روی نمونههای آب در آزمایشگاه انجام میشود. pH یکی از اندازهگیریهای مهم آب است، که اغلب هم در محل نمونهبرداری و هم در آزمایشگاه انجام میشود. مدلهای بزرگ و کوچکی از pH سنجها وجود دارند. مدلهای قابلحمل برای استفاده در این زمینه در دسترس هستند و مدلهای بزرگتر، مانند این یکی، در آزمایشگاه مورد استفاده قرار میگیرند.
برای استفاده از pH سنج در عکس زیر، نمونه آب در فنجان قرار داده میشود و پروب شیشهای در انتهای بازوی جمع شدنی در آب قرار میگیرد. داخل حباب شیشهای نازک در انتهای پروب دو الکترود وجود دارد که ولتاژ را اندازهگیری میکنند. یک الکترود در مایعی قرار دارد که اسیدیته یا pH ثابتی دارد. الکترود دیگر به اسیدیتهی نمونهی آب پاسخ میدهد. یک ولتسنج در پروب تفاوت بین ولتاژهای دو الکترود را اندازهگیری میکند. سپس کنتور تفاوت ولتاژ را به pH ترجمه میکند و آن را بر روی صفحه نمایش کوچکی در جعبه اصلی نشان میدهد.

قبل از اندازهگیری PH، دستگاه باید “کالیبره” شود. پروب در محلولی که pH شناختهشدهای دارد، مانند آب خالص با pH خنثی ۷ غوطهور میشود. از دکمههای روی دستگاه برای تنظیم مقدار pH نمایش داده شده به pH شناخته شدهی محلول و در نتیجه کالیبره کردن دستگاه استفاده میشود.
اندازهگیری pH در خانه یا مدرسه
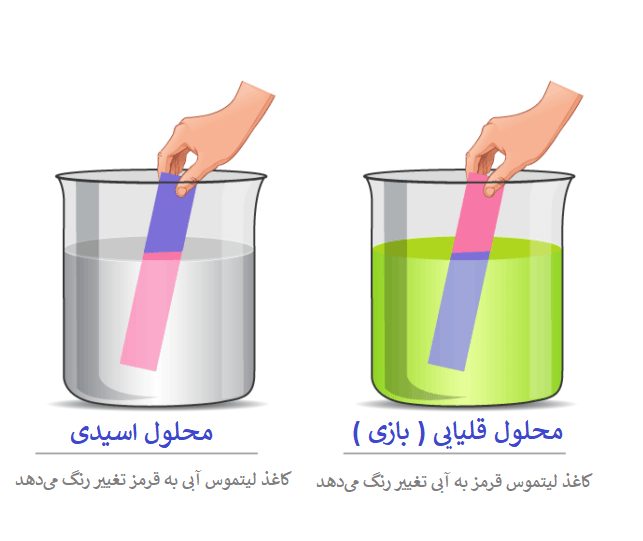
یکی از محبوبترین پروژههای علمی مدارس، گرفتن pH آب از منابع مختلف است. احتمالا مدرسهتان (و نه خودتان) pH سنج الکترونیکی در اطراف خود ندارد، اما شما هنوز هم میتوانید با استفاده از کاغذ لیتموس تخمینی از PH به دست آورید. کاغذ لیتموس، که در فروشگاههای عرضه حیوانات خانگی یافت میشود (برای بررسی PH آکواریوم)، تنها یک نوار کاغذی است که وقتی یک نمونه آب روی آن میچکد، به رنگ خاصی تغییر کرده، و تخمین خوب و دقیقی از PH میدهد.
pH و کیفیت آب
pHهای خیلی زیاد و کم میتوانند برای استفاده از آب مضر باشند. pH بالا باعث طعم تلخ میشود، لولههای آب و لوازم خانگی با استفاده از چنین آبی با رسوبات پوشیده میشوند، و کارآیی گندزدایی کلر کاهش مییابد، در نتیجه زمانی که pH آب بالاست به کلر اضافی نیاز است. آب با pH پایین فلزات و دیگر مواد را خورده یا حل خواهد کرد.
آلودگیها میتوانند pH آب را تغییر دهند که به نوبه خود میتواند به حیوانات و گیاهانی که در آب زندگی میکنند آسیب برساند. به عنوان مثال، آبی که از یک معدن زغالسنگ متروکه بیرون میآید میتواند 2=pH داشته باشد، که بسیار اسیدی است و قطعا بر هر ماهی که آنقدر دیوانه باشد که تلاش کند در آن زندگی کند، تاثیر میگذارد! با استفاده از مقیاس لگاریتمی، این زهاب معدنی ۱۰۰۰۰۰ برابر اسیدی تر از آب خنثی خواهد بود – بنابراین از معادن متروکه دور بمانید.